脊髓损伤修复是医学领域的一个具有挑战性的难题,近年来基于神经干细胞(NSCs)的疗法显示出巨大的潜力。但是大多数材料不能为神经干细提供合适的微环境,这使得神经干细胞在脊髓损伤部位的存活和可控分化仍然是一个挑战。
针对上述挑战,吉林大学第二医院骨科杨小玉教授课题组和吉林大学化学学院林权教授课题组合作共同提出一种仿生3D软支架结合电刺激调控神经干细胞分化引导脊髓损伤修复的治疗策略。研究成果以“Biomimicking 3D soft scaffold combined with electrical stimulation to manipulate neural stem cell differentiation for guidance spinal cord injury repair”为题发表在领域内顶刊《Materials Today》中科院一区,影响因子24.2。
设计和开发了一种模拟脊髓组织的导电水凝胶(CHM)作为仿生3D生物材料软支架,所设计的水凝胶在力学性能、电导率和孔隙结构方面与脊髓组织相匹配。该水凝胶可以有效改善NSCs的生存微环境,调节分化方向。水凝胶结合电刺激(ES)能有效诱导所负载的NSCs更多地向神经元分化、轴突生长和髓鞘再生,同时减少向星形胶质细胞方向的发育。
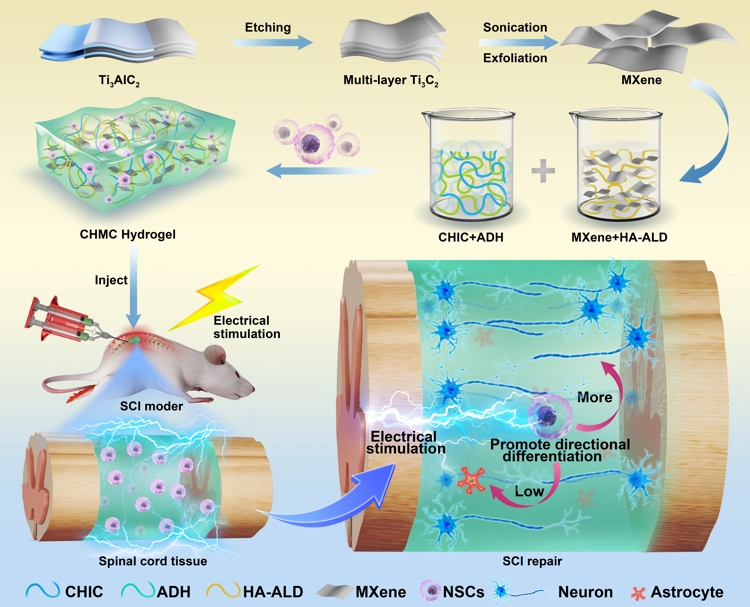
可注射导电CHM水凝胶的合成过程与电刺激协同作用,促进脊髓损伤修复
CHM水凝胶的网络由壳聚糖接枝儿茶酚(CHIC)和氧化透明质酸(HA-ALD)己二酰二肼(ADH)通过动态反应合成。并引入新型导电填料MXene为水凝胶提供与天然脊髓组织相匹配的导电性,并为后续结合电刺激治疗打下基础。
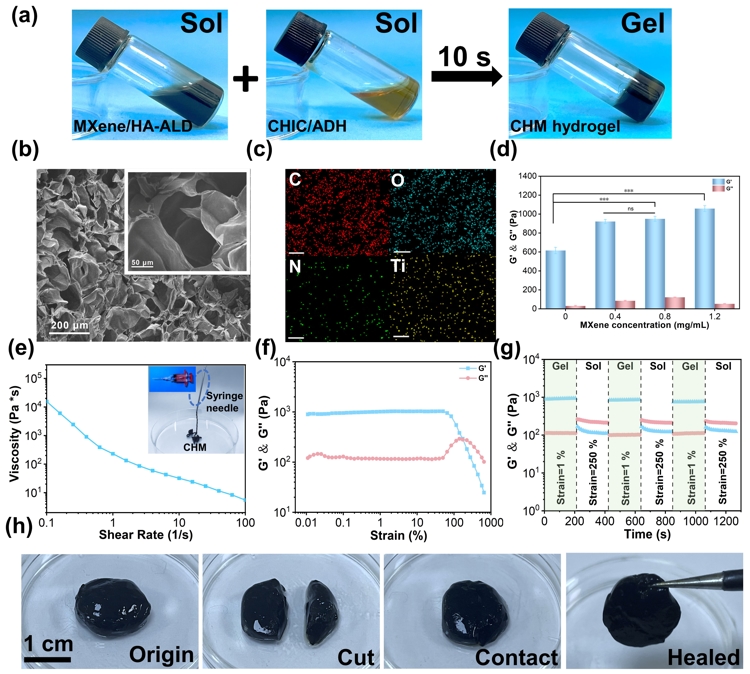
a) CHM水凝胶的凝胶化过程。b) CHM2水凝胶的SEM图像。c) CHM2水凝胶的EDS能谱图。d)不同MXene浓度CHM水凝胶的G′和G″。e) CHM2水凝胶剪切变稀。f) CHM2水凝胶应变振幅扫描。g) 自愈合流变。h) CHM2的宏观自愈过程。
在细胞实验中发现类似脊髓组织的CHM2水凝胶形成的导电微环境可以促进NSCs向神经元和轴突延伸的分化并可以减少向星形胶质细胞方向分化。当CHM2水凝胶结合电刺激不仅为NSCs提供了适宜的生长环境,而且形成了外源性电刺激与内源性电的结合。这种策略进一步增强了NSCs向神经元分化的能力和轴突自由延伸的长度。
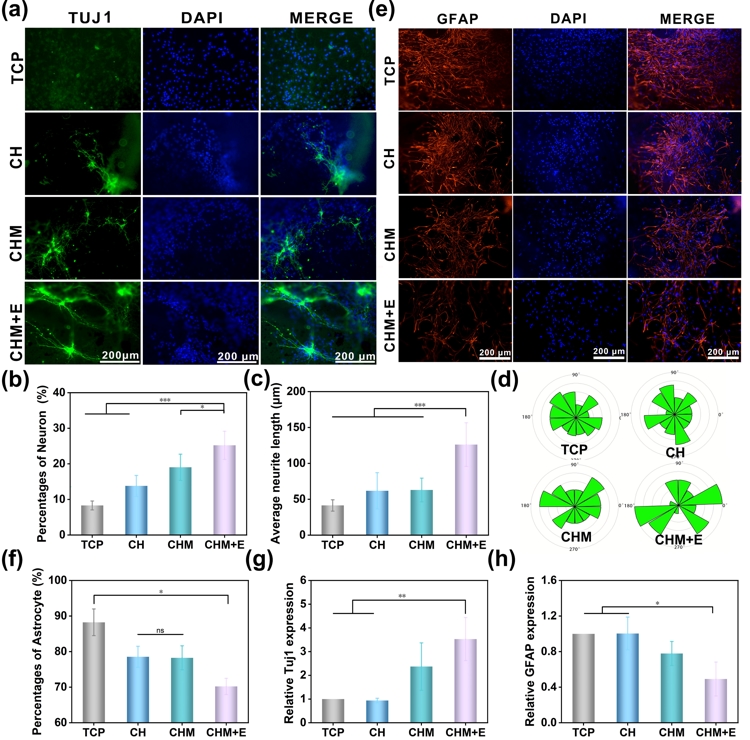
a) CHM水凝胶的共聚焦荧光显微照片。Tuj1用绿色表示,DAPI用蓝色表示。b)各组Tuj1神经元百分比。c)各组平均轴突长度统计。d)神经元轴突风玫瑰图,每个叶片表示相应角度范围内的轴突数。e)星形胶质细胞GFAP染色(红色)。f)各组GFAP星形胶质细胞百分比。g) RT-PCR检测Tuj1基因表达水平,h) GFAP。
评估CHM导电水凝胶的体内功效,在大鼠胸椎(T9)处进行了脊髓全切模型用载有NSCs的CHM2水凝胶填充脊髓损伤切口间隙并结合电刺激进行治疗。6周后运动功能基本恢复且脊髓损伤空腔面积明显减小还抑制胶质瘢痕沉。
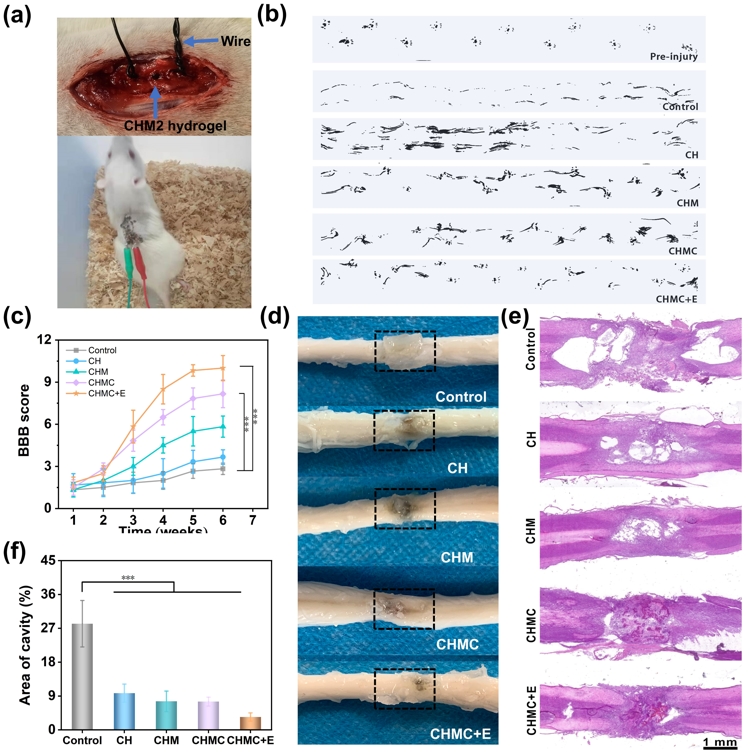
CHM2水凝胶联合ES对脊髓损伤大鼠运动功能的恢复。a)大鼠电极植入和电刺激过程。b)各组大鼠的脚印。c)术后第6周大鼠BBB评分。d)大鼠脊髓标本。e)脊髓切片H&E染色。f)各组脊髓腔面积统计。
吉大二院杨小玉教授和吉林大学化学学院林权教授为本文共同通讯作者,博士研究生冯斌、庾子元与为本文共同第一作者。
原文链接:https://doi.org/10.1016/j.mattod.2023.10.011

 亚泰院区
亚泰院区  正常工作时间
正常工作时间 自强院区
自强院区  青年院区
青年院区 官方微信公众号
官方微信公众号
用户登录
还没有账号?
立即注册